La fijación con formalina es un pilar del análisis histopatológico moderno, pero la práctica está poco estandarizada y es una fuente potencial importante de errores preanalíticos. Las preocupaciones sobre el flujo de trabajo y el tiempo de respuesta impulsan el interés en desarrollar protocolos de fijación más cortos, pero los protocolos rápidos pueden provocar una histomorfología deficiente o resultados de análisis posteriores inadecuados. Además, los ensayos como la inmunohistoquímica para epítopos fosforilados han sido históricamente un desafío en el contexto del tejido fijado con formalina, lo que indica que puede haber margen de mejora en este proceso que es fundamental para la práctica de la patología anatómica. Con estas cuestiones en mente, estudiamos la bioquímica básica de la formalina para desarrollar un nuevo protocolo de fijación de formalina que implica una preincubación en formalina a temperatura subambiente antes de una breve exposición a formalina calentada. Este nuevo protocolo es más rápido que los protocolos estándar, pero preserva la histomorfología y produce tejido que es compatible con un conjunto ampliado de ensayos clínicos y de investigación posteriores, incluida la inmunohistoquímica para epítopos fosforilados.
Introducción
En la década de 1890, el precursor industrial de Schering AG patentó una solución acuosa de formaldehído gaseoso con el nombre de “formalina”, y durante más de un siglo, los histotecnólogos han utilizado la formalina para preparar tejido para seccionarlo y examinarlo microscópicamente. A pesar de esta larga historia de uso, la química de las interacciones del formaldehído con los constituyentes de los tejidos se comprende menos completamente de lo que cabría esperar. Lo que se cree que ocurre cuando la formalina fija el tejido es que el formaldehído reticula las proteínas creando puentes de metileno entre los grupos amino adyacentes de las proteínas, otorgando así integridad estructural al tejido e inactivando enzimas potencialmente destructivas dentro del tejido. Sin embargo, esto es una simplificación excesiva y las interacciones del formaldehído con cada tipo de biomolécula en un tejido aún no se conocen bien. Tradicionalmente se piensa que las proteínas de los tejidos, por ejemplo, están simplemente entrecruzadas por formaldehído, pero pueden participar en más reacciones químicas con formaldehído que simplemente entrecruzándose. Los grupos amino de las proteínas no son los únicos objetivos de la formalina, como lo demuestran las observaciones de que los péptidos que carecen de grupos amino pueden «fijarse» reversiblemente y los no péptidos, como los ácidos nucleicos, también parecen alterarse mediante la fijación por medios no completamente comprendidos.
El comportamiento del formaldehído en los tejidos se ve aún más confuso por el hecho de que el formaldehído en solución, de hecho, en su mayor parte no es formaldehído. Más bien, está en equilibrio con un gran exceso de su hidrato no reactivo, el metilenglicol, de modo que sólo una pequeña fracción de las moléculas de la “formalina” son especies reactivas de formaldehído. Este último hecho puede explicar la observación tan repetida de que la formalina penetra rápidamente en los tejidos, pero los fija lentamente. A pesar de estas incertidumbres mecanísticas, la formalina sigue siendo una opción abrumadoramente popular como fijador en los laboratorios clínicos, a pesar de la existencia de múltiples estrategias de fijación alternativas.
La búsqueda de protocolos de fijación con formalina cada vez más rápidos ha sido impulsada históricamente por consideraciones sobre el tiempo de respuesta general del laboratorio y el flujo de trabajo, ya que la fijación con formalina y el procesamiento de tejidos pueden comprender la mayor parte del tiempo necesario para el análisis histopatológico. Los procesadores de tejidos comerciales diseñados para abordar esta necesidad reparan el tejido rápidamente aplicando formalina y energía externa en forma de calor o microondas. Es probable que el calor acelere la fijación por dos razones: en primer lugar, el equilibrio formaldehído-metilenglicol se desplaza hacia el formaldehído a temperaturas más altas y aumenta la concentración efectiva de la molécula activa, y en segundo lugar, la reticulación de proteínas, como muchas otras reacciones químicas, debería ser más rápida. rápidamente a temperaturas elevadas. El ultrasonido también se ha aplicado a la fijación como un mecanismo alternativo para impartir energía para acelerar la fijación.
Si bien la fijación acelerada con formalina calentada tiene beneficios potenciales al reducir los tiempos de respuesta clínica, nuestra experiencia y la de otros indican que la calidad de los estudios histológicos y moleculares se ve afectada en los protocolos calentados. Además, resulta preocupante que, salvo unas pocas aplicaciones clínicas, la fijación de tejidos no esté estrictamente estandarizada en el laboratorio clínico. Un laboratorio puede optar por fijar muestras de tejido clínico rápidamente a una temperatura elevada y otro puede optar por fijar lentamente a temperatura ambiente o baja, pero se espera que ambas condiciones preanalíticas funcionen adecuadamente para los ensayos posteriores basados en tejido. La influencia de la variación en la preparación de muestras preanalíticas se reconoce cada vez más como un problema importante en el diagnóstico patológico, ya que impide un análisis preciso y específico de la muestra de un paciente y la elucidación de la mejor terapia posible para una enfermedad, ambos aspectos esenciales. en el paradigma de la medicina personalizada. Se sabe que las modificaciones postraduccionales de proteínas, como la fosforilación, por ejemplo, son indicadores importantes de la actividad de la vía de señalización y representan biomarcadores clínicos prometedores, pero pueden ser muy difíciles de medir en tejidos fijos debido a variables preanalíticas. La fijación con formalina antes del análisis de fosfoproteínas debe entrecruzar las proteínas del tejido e inactivar las enzimas fosfatasas que podrían eliminar las proteínas fosfato; el fracaso en cualquiera de estas tareas en tejido fijado inadecuadamente hace imposible interrogar estas vías y utilizar tales ensayos como diagnóstico.

Se han adoptado parámetros de fijación estandarizados para algunos ensayos de biomarcadores clínicos para mitigar los errores derivados de la variación preanalítica, como las pautas de la Sociedad Estadounidense de Oncología Clínica/Colegio de Patólogos Estadounidenses (ASCO/CAP) para la IHC de HER2 que exigen la fijación en formalina tamponada neutra. durante al menos 6 horas y no más de 48 horas. Si bien estas pautas tienen buenas intenciones, aún permiten una variación de 8 veces en el tiempo de fijación y no pretenden representar condiciones óptimas para todos los ensayos de IHQ. Sin embargo, es muy poco probable que la gran cantidad de diferentes ensayos IHC desarrollados en laboratorio y realizados clínicamente en todo el mundo puedan validarse para todos los posibles protocolos de fijación. Ante este problema, buscamos identificar un protocolo de fijación de formalina estandarizado que fuera aplicable a una amplia gama de tipos de tejidos y optimizado tanto para la velocidad como para la preservación de las características moleculares de diagnóstico. Comenzando con estudios básicos de bioquímica de proteínas, desarrollamos racionalmente un nuevo protocolo de fijación basado en la bioquímica de formalina, demostramos su amplia aplicabilidad a la histopatología estándar y finalmente demostramos que el nuevo protocolo proporcionó resultados aceptables de ensayos IHC para numerosos objetivos, incluidos varios ensayos de fosfoproteínas.
OBJETIVOS
Elaborar y fomentar el uso de un protocolo de fijación de muestras anatomopatológicas que mayormente presentan problemas de fijación: como grasas procedentes generalmente de glándulas mamarias y úteros. Para ello debemos emplear el protocolo de fijación a diferentes temperaturas, el procedimiento debe ser guiado y dirigido por la persona a cargo del laboratorio de Histotecnología con el fin de garantizar una adecuada fijación de las muestras con mayor problema.
DATOS RELEVANTES
Si bien más del 90% de los casos que llegan a los servicios de patología son fijados con Formol Buferado y muestran una efectividad del 100%, existen algunos tejidos que por su consistencia o dureza no permiten una adecuada fijación. Entonces debemos seguir las siguientes recomendaciones para no incurrir en errores y así poder garantizar una excelente fijación, garantizando excelentes procedimientos como los estudios complementarios de: Histoquímica (HC), Inmunohistoquímica (IHC), Inmunofluorescencia (IF) e Hibridación In Situ (FISH – CISH – SISH).
- Revisar el adecuado desempeño del Formol, para esto debemos fijarnos en: El Lote, Fecha de Elaboración, Fecha de Expiración, Estado del recipiente que lo contenga, el PH. (7.0) y su adecuado almacenamiento. Si el recipiente por alguna razón se ve abollado o con algún tipo de perforación perderá de inmediato su adecuado desempeño, además de que puede ocasionar lesiones a nivel físico, como su exposición por largos períodos de tiempo causando cáncer de las vías respiratorias.
Generalmente, el formol es llevado a salas de cirugía y allí se envasa en recipientes de diferentes tamaños, en estos recipientes se deben llevar las muestras procedentes de los diferentes procedimientos quirúrgicos. Una mala operación, una mala manipulación, o rendir el formol sería incurrir en un error grave sin retroceso, Recordemos que una pieza mal fijada no se puede revertir. La forma más precisa para evidenciar este daño es cuando llevamos la pieza al interior del recipiente con formol rendido y la solución anteriormente incolora toma un color rojo claro sanguinolento. Al evidenciar esta reacción se debe inmediatamente el PH de la solución.
- En el momento de realizar los cortes macroscópicos es indispensable revisar el grosor del corte, una muestra demasiado gruesa no permite una adecuada perfusión de la solución al tejido. Los cortes no deben superar los 5 milímetros.
- Al recibir material graso como el procedente de Glándula mamaria, apéndice o lipectomías, se debe garantizar que el corte no supere los 5 milímetros, adicionalmente, se debe tratar de adelgazar lo que más se pueda, en caso de no hacerlo se debe procesar de forma convencional y luego, durante la inclusión tomar un paño seco y hacer ligera presión sobre el tejido con el fin de liberar el líquido que lo contiene. El tejido graso es encapsulado y se procura liberar líquido y mantener integra la estructura tisular.
- Los tejidos deben ser llevados a recipientes plásticos de diferentes tamaños, cuya única condición debe ser que el tejido u órgano a examinar quepa completamente en el y que el formol cubra el 75& del recipiente y que el 25% restante corresponda al tejido a estudiar. Utilizar bolsas plásticas no garantiza una excelente fijación, ya que el líquido al interior de este mecanismo toma la forma de la superficie que lo contiene, y en algunos casos la parte superior del tejido no obtendrá una adecuada fijación.
- Los órganos sólidos como: el corazón, el hígado y los pulmones entre otros han de ser cortados en rebanadas a máximo 1 cm de espesor y hasta las partes más profundas. De no realizarlo de esta manera, las partes más internas no se fijarán, este fenómeno visto al microscopio se evidenciará como grandes manchas azuladas no permitiendo la adecuada lectura de la muestra.
Protocolo estandarizado de formol a dos temperaturas 2+2
- La fijación consiste en la inmersión de las muestras en formalina tamponada neutra al 10 % (formaldehído acuoso saturado y tamponado a un pH de 6,8 a 7,2 con tampón fosfato 100 mM) durante 0 a 24 horas a temperaturas que oscilaban entre 4 ° C. a 50 ° La temperatura ambiente osciló entre 20 y 25 ° C.
- Las muestras de tejido recolectadas se deben fijar a temperatura ambiente durante 0, 2, 4 o 24 horas, o bien 2 horas en formalina a 4 ° Cseguidas de 2 horas en Formol a 45 ° C, denominándose este último protocolo “2+2”.
- Las muestras de formalina de 0 horas se colocan directamente en etanol al 70%.
- La fijación se lleva a cabo en vasos de precipitados cubiertos de 100 a 500 ml en un refrigerador para el tratamiento a 4 °C, en una campana extractora para el tratamiento a temperatura ambiente y en una campana extractora sobre una placa caliente para temperaturas elevadas (es decir, 45 ° C).
- Se transportaron 2+2 muestras desde el vaso refrigerado a la campana extractora para tratamientos de temperatura secuenciales. Las muestras se deben fijar a temperatura ambiente durante 10 a 48 horas en el laboratorio, siendo 10 horas el mínimo para muestras de lunes a viernes y 48 horas solo para muestras fijadas durante los fines de semana.
- Para facilitar el procesamiento de todas las muestras de investigación de un día en el mismo ciclo del procesador, todas las muestras se almacenaron en etanol al 70% después de una fijación de longitud variable antes de iniciar en el procesador de tejidos (con el equipo que cuente la institución de Presión/vacío).
- La ejecución del procesador se programó de la siguiente manera: 80 % de etanol durante 30 minutos, 95 % de etanol durante 60 minutos, 100 % de etanol durante 3 horas, xileno (xilol) durante 3 horas y parafina durante 3 horas 20 minutos. Los bloques se procesan mediante el mismo protocolo sin una preincubación variable con etanol al 70%. Todos los pasos del procesador de disolvente se mantuvieron a 45 °C bajo presión ambiente, y el paso de parafina se mantuvo a 60 ° C bajo vacío.
- Todas las muestras se incluyen en parafina y se cortan en portaobjetos de vidrio como secciones de 5 micrones para tinción de rutina con hematoxilina/eosina (H&E) o secciones de 4 micrones para estudios moleculares o IHC.

- Contenedor: Bolsa Plástica: El usuario suelta la bolsa y la deja descansar sobre el mesón. El líquido inmediatamente baja el volumen del líquido produciendo una mala fijación
en su parte superior. - Color: Inicialmente debe ser incoloro, al sumergir la muestra debe ser de tonalidad café oscura. El color sanguinolento indica que el formol fue rebajado con agua y por consiguiente altera
su PH.
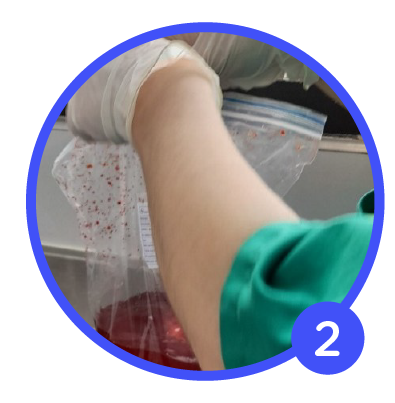
- Contenedor: Bolsa Plástica: El usuario suelta la bolsa y la deja descansar sobre el mesón. El líquido inmediatamente baja el volumen del líquido produciendo una mala fijación en su parte superior.
- Color: Inicialmente debe ser incoloro, al sumergir la muestra debe ser de tonalidad café oscura. El color sanguinolento indica que el formol fue rebajado con agua y por consiguiente altera su PH.
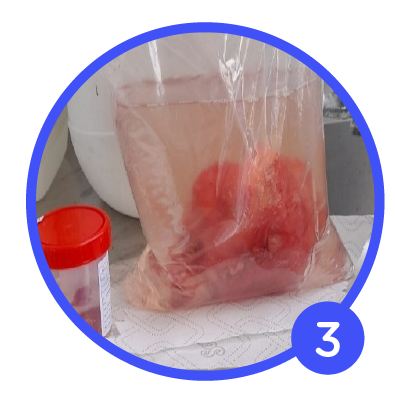
Contenedor:
- Bolsa Plástica: El usuario suelta la bolsa y la deja descansar sobre el mesón. El líquido inmediatamente baja el volumen del líquido produciendo una mala fijación en su parte superior.
- Frasco Plástico: La muestra se encuentra fijada correctamente.
- Color: Inicialmente incoloro, con el pasar de las horas debe tomar una tonalidad café si el tejido es rico en material hemorrágico.

Contenedor:
- Frasco Plástico: La muestra se encuentra
fijada correctamente. - Color: Inicialmente incoloro, con el pasar de las horas debe tomar una tonalidad café si el tejido es rico en material hemorrágico.
- PH: El PH no es el indicado. Debe ser de 7.0.

Contenedor:
- Frasco Plástico: La muestra se encuentra fijada correctamente.
- Color: Inicialmente incoloro, con el pasar de las horas debe tomar una tonalidad café si el tejido es rico en material hemorrágico.
- PH: El PH no es el indicado. Debe ser de 7.0.
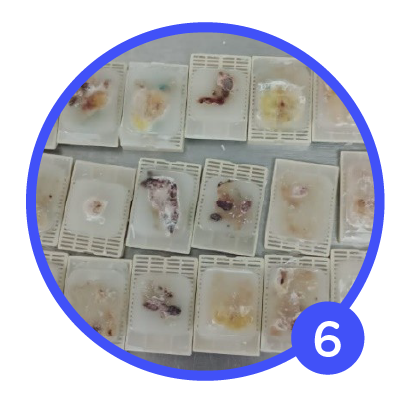
Se observa material procesado y en bloque con áreas blanquecinas que evidencian mala fijación.
RESULTADOS
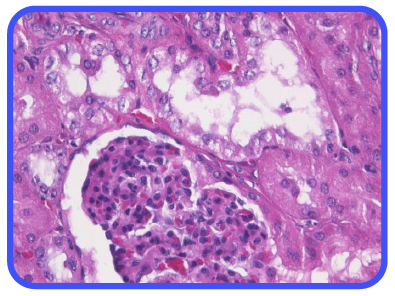
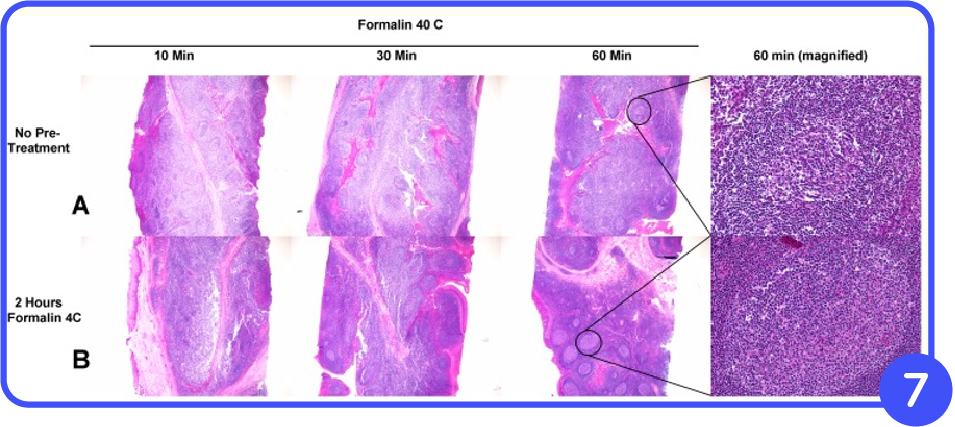
Uno de los problemas detectados con los protocolos de fijación normal con formalina buferada al 10% es que el fijador parece actuar muy rápidamente en los márgenes externos del tejido, pero el interior del tejido parece demorarse, antes de que el fijador haya tenido la oportunidad de actuar. Esto da como resultado una fijación desigual del tejido, una morfología deficiente y resultados de ensayos IHC poco confiables, como se ve en la fila A de la imagen 7. El tejido expuesto a formalina a 40°C durante 60 minutos produjo una fijación adecuada en la periferia del tejido y en el centro del tejido.

Análisis IHC de tejidos fijos con aumento de baja potencia.
(A, B, C, D) Bazo fijado en formalina a temperatura ambiente durante 0, 2, 4 o 24 horas, respectivamente, y teñido con IHC para la expresión de bcl-2.
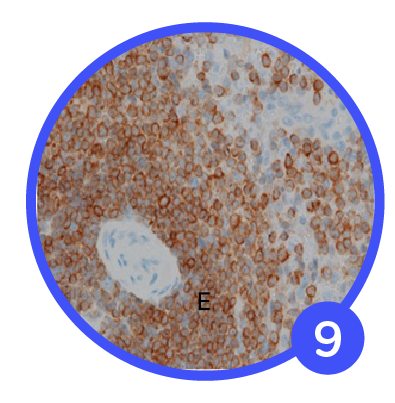
(E) Bazo fijado con protocolo 2+2 y teñido por IHC para expresión de bcl-2. Las imágenes tienen un aumento de 100×.
Discusión
Este protocolo rápido se desarrolló y se encuentra basado en múltiples pasos con temperatura controlada que reduce sustancialmente el tiempo de fijación del procedimiento estándar de aproximadamente 12 a 24 horas a 4 horas, al tiempo que preserva la información histomorfológica y molecular. Si bien los pasos posteriores del procesamiento de tejido (deshidratación, infiltración de parafina) pueden ser largos y en sí mismos introducen artefactos morfológicos preanalíticos y de IHC, debido a que se utilizaron condiciones idénticas de procesamiento de tejido en este estudio al hacer comparaciones entre los parámetros de fijación, se infiere que los efectos que aquí se describen son específicos de los pasos de fijación en sí, y no de los pasos de procesamiento posteriores
Conclusiones
- La fase preanalítica es fundamental para poder obtener excelentes resultados bajo el microscopio. Una muestra mal fijada no se puede recuperar, de hecho, se puede cometer cualquier error durante el procesamiento y se puede mejorar revirtiendo el proceso, pero una muestra mal fijada es irrecuperable, se puede tomar una nueva muestra en el caso de las biopsias, si queda material remanente de lesión, pero si la pieza es única incide en la vida de la paciente.
- El 98% del material recepcionado en patología presenta una excelente fijación si se sigue un protocolo adecuado de procesamiento, sin embrago, el 2% restante que corresponde a piezas que presentan alto grado de dificultad de procesamiento como tejido graso, se corrobora que si se emplea este protocolo rápido 2 + 2 reduce considerablemente esta cifra, evitando reprocesos o muestras inadecuadas e insatisfactorias, lo que conduce o repercute siempre a una inconformidad con el paciente bajo las condiciones preanalíticas de los diferentes Laboratorios de Patología.
- Se infiere que el protocolo rápido de 2 + 2 presenta una mejor conservación de material para análisis posteriores a los cortes de rutina, como en el caso de la histoquímica, inmunohistoquímica e Hibridación In Situ presentando una mejor estabilidad de la muestra.
- La metodología empleada también es útil para todos aquellos anticuerpos de inmunohistoquímica en los cuales se dificulta su adecuada marcación e interpretación. Un ejemplo claro son los anticuerpos como: El Bcl 6 y la Cyclina D 1 y los marcadores micro satelitales entre otros, lo cual genera reprocesos y altos costos en los procedimientos.
- La coloración de la muestra mejora considerablemente, lo que permite una mejor visualización al microscopio. También asegura que la calidad del tejido mejore, ya que los colorantes penetran mejor las estructuras al interior del tejido.
- Por consiguiente, se hace necesario utilizar este protocolo como recurso a piezas que presentan un alto grado de dificultad durante su fase preanalítica, el voz a voz y la práctica diaria nos indican que hoy en día contamos y podemos utilizar esta nueva herramienta o recurso para no incurrir en errores.
REFERENCIAS BIBLIOGRÁFICAS
- Fox CH, Johnson FB, Whiting J, Roller PP (1985) Fijación con formaldehído. J Histochem Cytochem 33 : 845–853. [ PubMed ] [ Google Scholar ]
- Sompuram SR, Vani K, Messana E, Bogen SA (2004) Un mecanismo molecular de fijación de formalina y recuperación de antígenos. Soy J Clin Pathol 121 : 190–199. [ PubMed ] [ Google Scholar ]
- Bussolati G, Annaratone L, Medico E, D’Armento G, Sapino A (2011) La fijación con formalina a baja temperatura preserva mejor la integridad del ácido nucleico. Más uno 6 : e21043. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- Winkelman J, Voorwinde O, Ottens M, Beenackers A, Janssen L (2002) Cinética y equilibrio químico de la hidratación del formaldehído. Ciencias de la ingeniería química 57 : 4067–4076. [ Google Académico ]
- Titford M (2012) Fijación con formalina. Arch Pathol Lab Med 136 : 137. [ PubMed ] [ Google Scholar ]
- Baloglu G, Haholu A, Kucukodaci Z, Yilmaz I, Yildirim S, et al. (2008) Los efectos de las alternativas de fijación de tejidos sobre el contenido de ADN: un estudio sobre tejido de colon normal. Appl Immunohistochem Mol Morphol 16 : 485–492. [ PubMed ] [ Google Scholar ]
- Cox ML, Schray CL, Lustre CN, Stewart ZS, Korytko PJ, et al. (2006) Evaluación de fijadores, fijación y procesamiento de tejidos sobre la morfología y la integridad del ARN. Exp. Mol Pathol. Estados Unidos. 183–191. [ PubMed] [ Google Scholar ]
- Gillespie JW, Best CJ, Bichsel VE, Cole KA, Greenhut SF, et al. (2002) Evaluación de la fijación de tejidos sin formalina para estudios de perfiles moleculares. Soy J Pathol. Estados Unidos. 449–457. [ Artículo gratuito de PMC] [ PubMed ] [ Google Scholar ]
- Nadji M, Nassiri M, Vincek V, Kanhoush R, Morales AR (2005) Inmunohistoquímica de tejido preparado mediante un sistema de procesamiento y fijación molecular. Appl Immunohistochem Mol Morphol. Estados Unidos. 277–282. [ PubMed] [ Google Scholar ]
- Umlas J, Tulecke M (2004) Los efectos de la fijación de glioxal en la evaluación histológica de muestras de mama. Hum Pathol. Estados Unidos. 1058–1062. [ PubMed] [ Google Scholar ]
- Uneyama C, Shibutani M, Masutomi N, Takagi H, Hirose M (2002) Fijación de metacarno para análisis de ADN genómico en muestras de tejido microdiseccionadas e incluidas en parafina. J Histochem Cytochem 50 : 1237-1245. [ PubMed ] [ Google Scholar ]
- Looi LM, Loh KC (2005) Fijación con formaldehído estimulada por microondas de tejidos de biopsia renal experimental: análisis morfométrico computarizado de artefactos de distorsión. Malayos J Pathol 27 : 23–27. [ PubMed ] [ Google Scholar ]
- Hafajee ZA, Leong AS (2004) Procesamiento de tejido ultrarrápido estimulado por microondas con un protocolo modificado que incorpora fijación por microondas. Patología. Inglaterra. 325–329. [ PubMed] [ Google Scholar ]
- Ferris AM, Giberson RT, Sanders MA, Day JR (2009) Técnicas avanzadas de laboratorio para el procesamiento de muestras e inmunomarcaje mediante radiación de microondas. Métodos J Neurosci 182 : 157–164. [ PubMed ] [ Google Scholar ]
- Boon ME, Kok LP, Ouwerkerk-Noordam E (1986) Difusión estimulada por microondas para un procesamiento rápido de tejido: tiempos reducidos de deshidratación, limpieza e impregnación. Histopatología 10 : 303–309. [ PubMed ] [ Google Scholar ]
- Boon ME, Gerrits PO, Moorlag HE, Nieuwenhuis P, Kok LP (1988) Fijación de formaldehído e irradiación con microondas. Histochem J 20 : 313–322. [ PubMed ] [ Google Scholar ]
- Boon ME, Marani E (1991) La mayor importancia de los datos de temperatura en las publicaciones sobre técnicas de microondas. Eur J. Morphol 29 : 184-185. [ PubMed ] [ Google Scholar ]
- Boon ME (1996) Recuperación de antígenos de microondas: la importancia del pH de la solución de recuperación para la tinción con MIB-1. Eur J. Morphol 34 : 375–379. [ PubMed ] [ Google Scholar ]
- Iesurum A, Balbi T, Vasapollo D, Cicognani A, Ghimenton C (2006) Procesamiento por microondas y fijación a base de etanol en patología forense. Soy J Forensic Med Pathol. Estados Unidos. 178–182. [ PubMed] [ Google Scholar ]
- Kok LP, Boon ME (1990) Física de la tecnología de microondas en histoquímica. Histochem J 22 : 381–388. [ PubMed ] [ Google Scholar ]
- Leong AS, Daymon ME, Milios J (1985) La irradiación por microondas como forma de fijación para microscopía óptica y electrónica. J. Pathol 146 : 313–321. [ PubMed ] [ Google Scholar ]
- Leong AS, Duncis CG (1986) Un método de fijación rápida de grandes muestras de biopsia mediante irradiación con microondas. Patología 18 : 222–225. [ PubMed ] [ Google Scholar ]
- Leong AS (1988) Irradiación por microondas en histopatología. Pathol Annu 23 parte 2 : 213–234. [ PubMed ] [ Google Scholar ]
- Ruijter ET, Miller GJ, Aalders TW, van de Kaa CA, Schalken JA, et al. (1997) Fijación rápida estimulada por microondas de muestras completas de prostatectomía. Grupo de Estudio MPC Biomed-II. J Pathol. Inglaterra. 369–375. [ PubMed] [ Google Scholar ]
- Chen Q, Zou X, Cheng J, Wu J (2007) Aplicación de ultrasonido en la preparación de secciones patológicas para reducir el tiempo de procesamiento. Ultrasonidos. Países Bajos. 78–81. [ PubMed] [ Google Scholar ]
- Chu WS, Furusato B, Wong K, Sesterhenn IA, Mostofi FK, et al. (2005) La fijación de tejido con formalina acelerada por ultrasonido mejora la morfología, la preservación de antígenos y ARNm. Mod Pathol. Estados Unidos. 850–863. [ PubMed] [ Google Scholar ]
- Chu WS, Liang Q, Tang Y, King R, Wong K, et al. (2006) La fijación/procesamiento de tejido acelerado por ultrasonido logra una morfología e integridad de macromoléculas superiores con estabilidad de almacenamiento. J Histochem Cytochem. Estados Unidos. 503–513. [ PubMed] [ Google Scholar ]
- Fracasso T, Heinrich M, Hohoff C, Brinkmann B, Pfeiffer H (2009) La fijación con formalina acelerada por ultrasonido mejora la preservación de la extracción de ácidos nucleicos en secciones histológicas. Int J Legal Med 123 : 521–525. [ PubMed ] [ Google Scholar ]
- Zou N, Liang Q, He H, Liu J, Ji A, et al. (2011) Fijación con formalina de muestras biológicas facilitada por ultrasonido. Biotech Histochem 86 : 413–420. [ PubMed ] [ Google Scholar ]
- Durgun-Yücel B, Dere F, Yücel AH, Oguz O (1992) Fijación rápida de muestras de órganos completos y problemas concomitantes. Acta Med Okayama 46 : 75–81. [ PubMed ] [ Google Scholar ]
- Ericsson JL, Biberfeld P (1967) Estudios sobre la fijación de aldehídos. Tasas de fijación y su relación con la estructura fina y algunas reacciones histoquímicas en el hígado. Lab Invest 17 : 281–298. [ PubMed ] [ Google Scholar ]
- Dawson IM (1972) Fijación: ¿qué debe hacer el patólogo? Histochem J 4: 381–385. [ PubMed ] [ Google Scholar ]
- O’Leary TJ (2001) Estandarización en inmunohistoquímica. Appl Immunohistochem Mol Morphol 9 : 3–8. [ PubMed ] [ Google Scholar ]
- Leong AS, Leong TY (2011) Estandarización en inmunohistología. Métodos Mol Biol 724 : 37–68. [ PubMed ] [ Google Scholar ]
- Pierceall WE, Wolfe M, Suschak J, Chang H, Chen Y, et al. (2011) Estrategias para la normalización de la puntuación H de variables técnicas preanalíticas con utilidad potencial para la cuantificación de biomarcadores basados en inmunohistoquímica en el diagnóstico de respuesta terapéutica. Anal Cell Pathol (Amst) 34 : 159-168. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- Siddiqui S, Rimm DL (2010) Variables preanalíticas y anticuerpos fosfoespecíficos: el talón de Aquiles de la inmunohistoquímica. Res. del cáncer de mama. Inglaterra. 113. [ Artículo gratuito de PMC] [ PubMed ] [ Google Scholar ]
- Pinhel IF, Macneill FA, Hills MJ, Salter J, Detre S, et al. (2010) Pérdida extrema de p-Akt y p-Erk1/2 inmunorreactivos durante la fijación de rutina del cáncer de mama primario. Cáncer de mama Res 12 : R76. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- Bonnas C, Specht K, Spleiss O, Froehner S, Dietmann G, et al. (2011) Efectos de la isquemia fría y el microambiente tumoral inflamatorio en la detección de patrones de activación de las vías PI3K/AKT y MAPK en muestras clínicas de cáncer. Int J Cáncer. [ PubMed] [ Google Scholar ]
- Baker AF, Dragovich T, Ihle NT, Williams R, Fenoglio-Preiser C, et al. (2005) Estabilidad de la fosfoproteína como marcador biológico de señalización tumoral. Clin Cancer Res 11 : 4338–4340. [ PubMed ] [ Google Scholar ]
- Bai Y, Tolles J, Cheng H, Siddiqui S, Gopinath A, et al. (2011) La evaluación cuantitativa muestra la pérdida de epítopos antigénicos en función de variables preanalíticas. Lab Invest 91 : 1253-1261. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- Fogh J, Fogh JM, Orfeo T (1977) Ciento veintisiete líneas de células tumorales humanas cultivadas que producen tumores en ratones desnudos. J Natl Cancer Inst 59 : 221–226. [ PubMed ] [ Google Scholar ]
- Rolls G, Farmer N, Tarbet F (2008) Evaluación de la calidad del procesamiento de tejidos y el rendimiento de Peloris utilizando el sistema de puntuación de Leica Microsystems. Microsistemas Leica. [ Google Académico]
- Rait VK, O’Leary TJ, Mason JT (2004) Modelado de fijación de formalina y recuperación de antígenos con ribonucleasa A pancreática bovina: alteraciones estructurales y funcionales. Inversión en laboratorio. Estados Unidos. 292–299. [ Artículo gratuito de PMC] [ PubMed ] [ Google Scholar ]
- Fowler CB, O’Leary TJ, Mason JT (2008) Modelado de fijación de formalina y procesamiento histológico con ribonucleasa A: efectos de la deshidratación de etanol en la reversión de los enlaces cruzados de formaldehído. Inversión en laboratorio. Estados Unidos. 785–791. [ PubMed] [ Google Scholar ].
Elaborado por: Alexander Juyo M, Especialista de Producto – Línea de Patología
ANNAR Health Technologies
Enero de 2025








