
El síndrome urémico hemolítico (SUH) es una enfermedad grave, caracterizada por falla renal aguda, asociada a trombocitopenia y anemia hemolítica.
Este cuadro es precedido por síntomas digestivos como diarrea o diarrea con sangre, pudiendo presentarse además vómitos, irritabilidad y en algunos casos convulsiones.
Este síndrome se asocia generalmente a la infección intestinal causada por la bacteria Escherichia coli productora de toxina Shiga (Stx), que cursa con dolor y diarrea sanguinolenta usualmente auto-resolutiva, sin embargo, puede complicarse y generar insuficiencia renal aguda en niños (SUH), trastornos de coagulación en adultos (Púrpura trombocitopénica trombótica -o PTT-), complicaciones cardiacas e incluso neurológicas. Esta enfermedad es la principal causa de falla renal aguda en la infancia y la segunda causa de trasplante renal en la adolescencia, afectando también adultos mayores y personas inmunosuprimidas.
Tipos de E. coli y patogenicidad
La producción de toxinas es el principal factor de patogenicidad, siendo responsables de las complicaciones intestinales y sistémicas. Las distintas cepas de E. coli se clasifican en seis grupos en función de sus mecanismos de patogenicidad y factores de virulencia: E. coli enteropatogénica (EPEC), E. coli enterotoxigénica (ETEC), E. coli enteroinvasiva (EIEC),

E. coli enteroagregativa (EAEC), E. coli con adherencia difusa (DAEC) y E. coli enterohemorrágica, verotoxigénica o productora de toxinas Shiga (EHEC/VTEC/STEC), siendo esta última la causante del síndrome urémico hemolítico (SUH).
Toxina Shiga y desarrollo del síndrome hemolítico urémico
La E. coli productora de toxina Shiga (STEC) se caracteriza por su alto potencial de expresión de una o más toxinas, de acuerdo con la presencia de los genes Stx en el genoma bacteriano, los cuales son llevados por bacteriófagos lisogénicos y pueden ser transferidos horizontalmente.
Estas toxinas están compuestas por dos subunidades proteicas A y B. La subunidad B está constituida por cinco unidades idénticas que permiten su unión al receptor específico, el glucolípido Gb3 de la célula blanco, una vez unida al receptor es endocitada causando el bloqueo de la síntesis proteica y provocando la muerte de las células que poseen el receptor tales como las del epitelio intestinal y el endotelio renal.
De acuerdo con la secuencia de sus aminoácidos y la reacción serológica que generen, se dividen en dos tipos: Stx1 distinguiendo tres subtipos (a, c y d, las cuales pueden ser idénticas a la toxina producida por Shigella dysenteriae tipo 1) y Stx2 con sus subtipos (a, b, c, d, e, f y g, siendo f el que más difiere genotípica y fenotípicamente respecto a los demás dificultando su identificación y seguimiento epidemiológico).
Las infecciones por STEC son generalmente zoonóticas o pueden transmitirse de persona a persona, generando una gran variedad de síntomas como diarrea no complicada, dolor abdominal, náuseas, vómito, fiebre, diarrea sanguinolenta y síndrome hemolítico urémico el cual es potencialmente mortal.

Los síntomas característicos de SUH (anemia hemolítica no inmune, trombocitopenia y falla renal aguda) son generados por la activación y desregulación de las proteínas del sistema complemento que ocasionan el daño celular a nivel endotelial, el desarrollo del estadio inflamatorio y la agregación plaquetaria desencadenando microangiopatías trombóticas que conducen al daño multiorgánico.
Las falencias en la detección de las toxinas Shiga pueden conllevar a estados graves de la enfermedad como insuficiencia renal crónica, complicaciones cardiacas, complicaciones neurológicas e incluso a la muerte considerando además que las cepas productoras de Stx2 se asocian más comúnmente a consecuencias clínicas más severas del SUH que las productoras de Stx1 o de ambas.
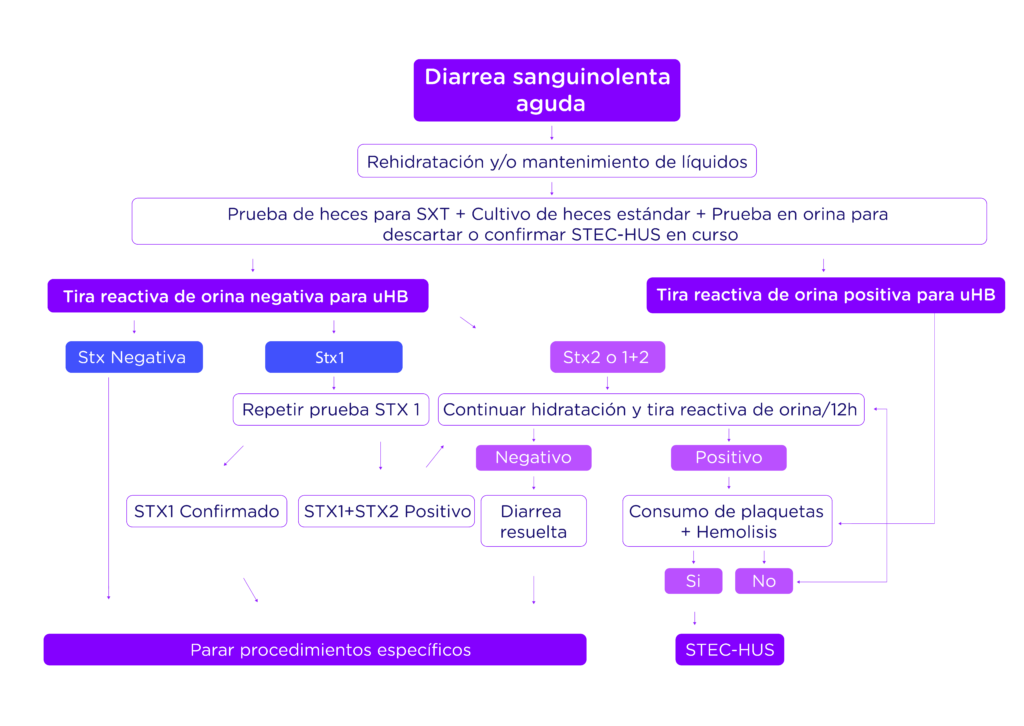
Impacto clínico de la diferenciación de Stx1 y Stx2 en el diagnóstico y tratamiento del Síndrome Urémico Hemolítico
El diagnóstico oportuno del SHU y la detección de las toxinas Stx1 y Stx2 es relevante desde el punto de vista clínico, económico y de salud pública, puesto que es fundamental para disminuir la presentación de estados graves. Actualmente, en el mercado se encuentran disponibles diferentes tecnologías orientadas a la detección de las toxinas Shiga, sin embargo, solo una de estas es capaz de diferenciar Stx1 y Stx2: QIAstat-Dx® Gastrointestinal Panel 2 de la casa matriz Qiagen.
Diferentes estudios realizados a nivel mundial han demostrado que este panel no solo permite la diferenciación de ambas toxinas, lo cual tiene una repercusión importante en el tratamiento y seguimiento del cuadro clínico, sino que también permite la detección del subtipo Stx2f el cual no puede ser detectado por otras opciones diagnósticas impactando significativamente el reporte final emitido. Lo anterior se debe al diseño de las plataformas para la detección de E. coli enteropatogénica (EPEC) basado en la identificación del gen eae o intimina, relacionado a la adherencia de las bacterias a los enterocitos para la destrucción de microvellosidades.
Este gen no es exclusivo del grupo EPEC pudiendo estar presente en STEC, lo cual implica que las técnicas sin distinción de los subtipos de toxinas clasificaran incorrectamente a posibles cepas STEC productoras de Shiga Stx2f como EPEC alterando el algoritmo de diagnóstico y tratamiento a seguir.
La detección precisa de Stx2 evita el uso de antibióticos que agudizan gravemente los síntomas del paciente y le permite al cuerpo médico elegir tratamientos dirigidos como son el suministro masivo de líquidos que limitan el agotamiento del volumen intravascular, reduciendo la formación de trombos, la hipoperfusión de órganos, la hipoxia y daño isquémico que conllevan a la fase grave del síndrome urémico hemolítico.

El síndrome urémico hemolítico es una enfermedad huérfana de alto impacto para la población pediátrica en la cual tiene mayor prevalencia. El uso de tecnologías que permitan la detección y diferenciación de las toxinas Stx1 y Stx2 amplía la perspectiva del cuerpo médico para brindar un tratamiento dirigido y oportuno que evite complicaciones graves como la deficiencia renal, afectaciones a nivel cardiaco y neurológico e incluso la muerte de los pacientes afectados. Con la tecnología de Qiastat con la que cuenta ANNAR Health Technologies puedes realizar la diferenciación de las toxinas por PCR multiplex en el panel gastrointestinal.

Bibliografía:
- Characterization of Atypical Shiga Toxin Gene Sequences and Description of Stx2j, a New Subtype.
- Early Volume Expansion and Outcomes of Hemolytic Uremic Syndrome DOI: 10.3265/Nefrologia.pre2012.Nov.11781, Acceso a texto complete Actualización en síndrome hemolítico urémico atípico: diagnóstico y tratamiento. Documento de consenso.
- Escherichia coli encoding Shiga toxin subtype Stx2f causing human infections in England, 2015–2022.
- Bloody Diarrhea and Shiga Toxin–Producing Escherichia coli Hemolytic Uremic Syndrome in Children: Data from the ItalKid-HUS Network.
- Microangiopatía trombótica. Síndrome hemolítico urémico.
- Hemoglobinuria for the early identification of STEC-HUS in high-risk children: data from the ItalKid-HUS Network.
- Detection of Shiga toxin-producing and other diarrheagenic Escherichia coli by the BioFire FilmArray® Gastrointestinal Panel in human fecal samples.
- An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document.
- Josep M. Campistola, Manuel Ariasb, Gema Aricetac, Miguel Blascoa, Mario Espinosad, Josep M. Grinyóe, Manuel Pragaf, Roser Torrag, Ramón Vilaltah, Santiago Rodríguez de Córdobai.
- Boyer O, Niaudet P. Hemolytic-Uremic Syndrome in Children. Pediatr Clin North Am. 2022 Dec;69(6):1181-1197. doi: 10.1016/j.pcl.2022.07.006. Epub 2022 Oct 29. PMID: 36880929.
- Hannaoui Rodríguez, Erika Josefina, Villalobos, Luz Bettina, & artínez Nazaret, Rosa Elena. (2009). Escherichia coli shigatoxigénica: Patogénesis, diagnóstico y tratamiento. Revista de la Sociedad Venezolana de Microbiología, 29(1), 13-20. Recuperado en 05 de abril de 2024, de http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1315-25562009000100004&lng=es&tlng=es.








